ISO 13485: Ein klar definierter Qualitätsstandard im internationalen Geschäft
Die Einhaltung klar definierter Qualitätsstandards wird in der heutigen Zeit - und insbesonders im internationalen - Geschäft immer wichtiger. Dazu gehört unter anderem die Fähigkeit, sich an ständig verändernde Märkte und Kundenanforderungen anzupassen und entsprechend kontinuierliche Lern- und Verbesserungsprozesse aufzusetzen.
Die DIN EN ISO 13485 als Qualitätsmanagementsystem für Medizinprodukte beschreibt Anforderungen für regulatorische Zwecke, und befasst sich mit der Entwicklung, Implementierung und Aufrechterhaltung eines Qualitätsmanagementsystems für Hersteller und Lieferanten von Medizinprodukten.
Der Standard enthält detaillierte Anforderungen für ein Qualitätsmanagementsystem, das sowohl die Kundenanforderungen als auch die Anforderungen an alle Bereich im Lebenszyklus eines Medizinproduktes, seiner Rohstoffe und Komponenten sowie der einschlägigen Dienstleistungen erfüllt.




Vorteile einer ISO 13485 Zertifizierung
- Nachhaltige Qualitätssicherung
- Identifikation von Verbesserungs- und Einsparpotentialen
- Hohe Kundenzufriedenheit
- Bildverbesserung
- Risikominimierung
- Bessere Wirtschaftlichkeit durch Prozessverbesserung
- Steigerung der Wettbewerbsfähigkeit
- Erfüllung spezifischer Kundenanforderungen
Der Auditablauf einer ISO 13485 Zertifizierung

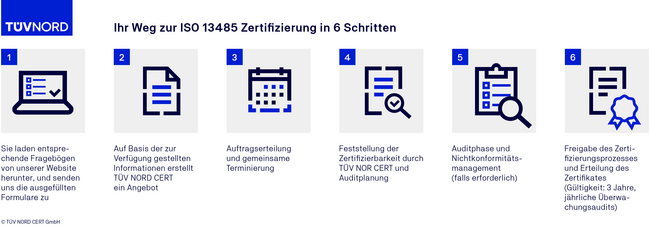
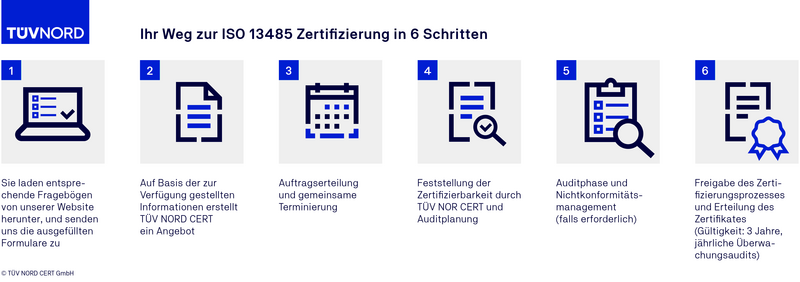
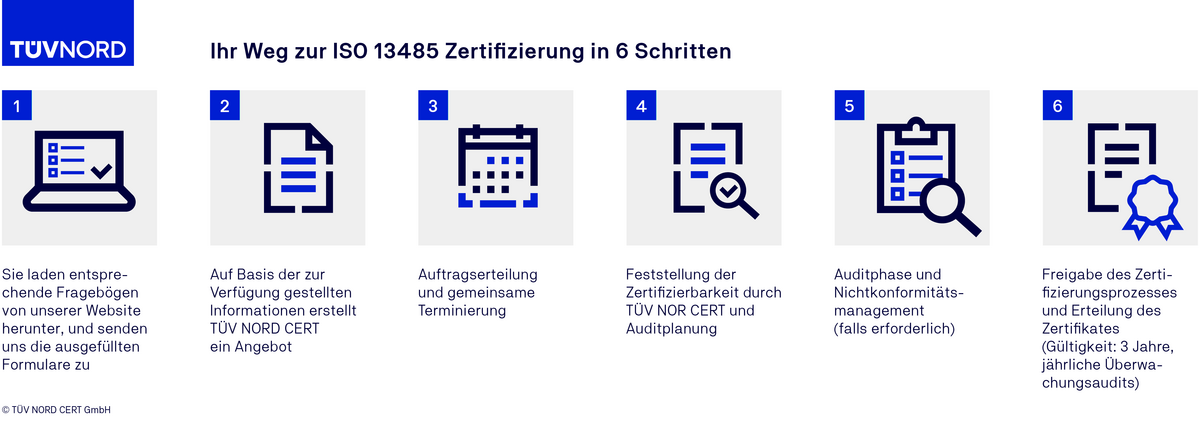
Akkreditierung und Benennung TÜV NORD CERT
Wir sind als Zertifizierer von Managementsystemen für Medizinprodukte nach der DIN EN ISO 13485 von der Deutschen Akkreditierungsstelle (DAkkS) akkreditiert. Des weiteren ist TÜV NORD CERT Benannte Stelle (Kennnummer 0044) für aktive und nicht aktive Medizinprodukte von der Zentralstelle der Länder für Gesundheitsschutz bei Arzneimitteln und Medizinprodukten (ZLG).
FAQ zur ISO 13485
Die DIN EN ISO 13485 ähnelt in Umfang und Absicht der DIN EN ISO 9001, enthält jedoch zusätzliche Anforderungen für Medizinprodukte und schließt bestimmte ISO 9001 Bestimmungen aus. Daher ist die Zertifizierung nach ISO 9001 in den meisten Ländern kein akzeptabler Ersatz für eine Zertifizierung nach DIN EN ISO 13485.
Durch ein funktionierendes Managementsystem können individuelle Unternehmensstrukturen exakt auf die spezifischen Bedürfnisse und Vorgaben des Kunden zugeschnitten werden. Betriebsabläufe können anschließend flexibel gestaltet werden, so dass jeder davon profitieren kann.
Produkte der Klasse I bringt der Hersteller in eigener Verantwortung in Verkehr. Für Produkte der Klassen Im, Is, Ir, IIa, IIb und III ist ein Konformitätsbewertungsverfahren unter Einbindung einer Benannten Stelle notwendig. TÜV NORD CERT ist Benannte Stelle nach Verordnung (EU) 2017/745 über Medizinprodukte (MDR).
- Ständige Verbesserung
- Prävention von Nichtkonformität
- Kontrolle der Lieferkette
- Identifizierung und Überwachung von qualitätsbezogenen Kennzahlen
- Produktsicherheit
- Ermittlung der Kundenzufriedenheit
- Getrennte Betrachtung der Produkt- und Prozessentwicklung
- Interdisziplinäre Zusammenarbeit
- Implementierung und Überwachung eines QM-Systems für Medizinprodukte, deren Rohstoffe und Komponenten sowie assoziierte Dienstleistungen
Ein QM-System nach DIN EN ISO 13485 bildet eine ideale Basis für moderne Organisationen jeder Größe auf nationaler und internationaler Ebene, um ihre Kompetenz und Effizienz unter Beweis zu stellen. Interne Arbeitsprozesse, Verantwortlichkeiten und Kompetenzen werden ebenso berücksichtigt wie die Regelung von Prozessen im Umgang mit Kunden und Geschäftspartnern.